学術研究用酵素 ENZYME
プロトプラストの概要
植物組織を植物組織崩壊酵素で単細胞化させ、細胞壁分解酵素で処理すると、細胞壁が溶解して細胞膜に包まれた球状の細胞ができます。
これを「プロトプラスト」といいます。プロトプラストは、異なる種類の植物の細胞同士を融合して新植物を作ったり、細胞内に遺伝子を導入することで植物に新たな性質を獲得させるなど細胞工学の目的で使われています。
プロトプラスト調製のイメージ


製品概要
| 10g品(従来品) | |||
|---|---|---|---|
| 製品名 | セルラーゼ オノズカ® R-10 |
セルラーゼ オノズカ® RS |
マセロチーム® R-10 |
| 酵素力価 | 10,000u以上/g | 16,000u以上/g | 3,000u以上/g |
| 包装 |  |
 |
 |
| 10g/褐色瓶 | |||
| 特長 | 天然セルロース分解力を有し、植物の細胞壁を溶解します。 植物葉肉細胞、培養細胞のプロトプラスト調製に適しています。 |
ペクチナーゼ、ヘミセルラーゼなどを高力価で含有し、植物組織を崩壊して単細胞化させます。 | |
| 至適pH | pH4.0-5.0 | pH5.0-6.0 | |
| 至適温度 | 40-55℃ | 40-50℃ | |
溶解性向上
| バイアル品 | ||
|---|---|---|
| セルラーゼ オノズカ® R-10 |
セルラーゼ オノズカ® RS |
マセロチーム® R-10 |
| 10,000u以上/ バイアル |
16,000u以上/ バイアル |
3,000u以上/ バイアル |
 |
 |
 |
| 5バイアル/化粧箱 | ||
| 天然セルロース分解力を有し、植物の細胞壁を溶解します。 植物葉肉細胞、培養細胞のプロトプラスト調製に適しています。 |
ペクチナーゼ、ヘミセルラーゼなどを高力価で含有し、植物組織を崩壊して単細胞化させます。 | |
| pH4.0-5.0 | pH5.0-6.0 | |
| 40-55℃ | 40-50℃ | |
あらかじめ小分けされたバイアルタイプが追加されました
従来品1g相当量に小分けされているため溶液調製時に秤量する手間が省けます。

バイアル品の優れた溶解性
従来品より溶解性を改善し作業性・操作性が格段に向上しました。


プロトプラストの歩み
なぜプロトプラストをつくるか?
植物細胞の特徴は、丈夫な細胞壁に囲まれていることであり、その積み重ねで植物体は構成されている。したがって、細胞壁の存在は植物に重要であるが、その細胞壁は細胞の生命活動の結果できたものであるので、生命活動を担うプロトプラストはより重要であるということができる。細胞を浸透圧の高い高張液におくと原形質分離が起こり、プロトプラストと細胞壁は分離することから、原形質分離によって形成されるプロトプラストは、植物における最小の生命ユニットであるという認識は19世紀末よりあった。また、細胞学説の提示以来、そのユニットを単独で培養すると、どのようにふるまうかという興味もごく初期から持たれていた。そのプロトプラストを取り出して、その性状を調べてみたいというのは自然な流れである。1909年に、ドイツのキュスター(Ernst Küster)は、原形質分離した植物細胞の一端を鋭い剃刀で切ってその内容物を絞り出し、プロトプラストを単離する試みを行ったが、得られる量が少ないので研究の展開はなかった1)。1960年になって、イギリスのコッキング(Edward C. Cocking)は木材腐朽菌Myrothecium verrucariaを自ら培養し、分泌された酵素を精製してセルラーゼを得た。これを用いて、トマトの根組織からプロトプラスト調製を行ったが、得られる量が限定的であることには変わりなかった2)。
タバコ葉肉プロトプラスト
1968年になって、建部らはヤクルト薬品工業㈱(当時は、近畿ヤクルト製造㈱が製造していた)で工業用に多量に生産されている酵素中に見出されたセルラーゼ・オノズカ R-10およびマセロチーム R-10を用いると、タバコ葉より多量のプロトプラストが調製できることを示した3)。マセロチームは クモノスカビ (Rhizopus sp.) より得られ、セルラーゼ・オノズカは不完全菌類 Trichoderma virideより得られている。手法的には、最初マセロチームで葉組織のペクチン質を分解することにより、細胞をバラバラに単離し、続いてセルラーゼでプロトプラストとする二段階法であるが、二つの酵素を混合する一段階法によっても得られる。その結果、一枚の葉から数千万個のプロトプラストが調製された(図1)。建部らは、これを用いてタバコモザイクウイルス (TMV) を効率よく感染させる一段階増殖系を確立し4)、TMWの感染初期過程の分子機構について明らかにした。一段階増殖系とは、もともとファージをバクテリアに感染させて得られる同調的なウイルスの増殖系であり、それにより分子生物学の黎明期の華々しい成果が得られた。デルブリュック(Max Delbrück)らの研究においてその成果を見ることができる5)。TMVは、最初に結晶化されたウイルスにもかかわらず、その増殖機構に関する解明の進展がなかったが、進展の端緒が得られることとなった。これは、植物プロトプラスト研究のその後の展開の幕開けとなった。
図1 タバコ葉肉プロトプラスト

一枚の葉にはおよそ5-7×107個の葉肉細胞があるが、それらからプロトプラストが調製できる。なお、工夫により、表皮や孔辺細胞からもプロトプラストは得られる。
プロトプラストよりの植物体再生
単離されたプロトプラストの培養は多く試みられていたが、成功例はほとんど見られていなかった。また、葉の細胞を培養するというアイデアは、1902年のハーバーランド(Gottlieb Harberlandt)の提案に始まるが6)、1964年の時点でもっとも著名なホワイト(Philip R. White)の細胞組織培養のモノグラフでも、葉細胞の培養はほとんど不可能であろうとされていた7)。ところが、長田と建部は単離されたタバコ葉肉プロトプラストを培養する際、調製材料を適正に選ぶことで、葉肉プロトプラストは培養にきわめて好適となり、細胞分裂の進行も同調的であることを示した8)。実際、細胞集団は12時間後にはDNA合成を始め、24時間後には細胞分裂が起こり(図2)、72時間後にはほとんどすべての細胞で完了し、細胞生物学的解析にも好適な材料であることを示した。さらに、培地条件を適切に選択した上で、寒天培地に埋め込むと高い頻度でコロニーを形成して、高等植物細胞をあたかも微生物のように取り扱えることも示した(図3)。得られたコロニーを器官分化条件に移すと、植物体の再生が可能であるということが初めて示された(図4、5)。
植物細胞の分化全能性は、1960年代前半に原理として示されていたが、タバコ葉肉プロトプラストの培養系は体細胞の分化全能性がほぼ100%であることを示した最初の例となった9)。この方法は、ジャガイモ葉から得たプロトプラストよりの植物体再生に適用されたが、得られた植物体はそれだけで育種目的にかなう遺伝的性質を示していると報告された10)。そして、プロトプラストは多くの植物種とそれらの組織から調製され、植物体再生が次々と行われるようになった。
植物プロトプラストはポリエチレングリコールを用いると細胞融合が誘導されることが示されたことから、「体細胞雑種遺伝学」という新領域が展開されることとなった。その一例はジャガイモとトマトの体細胞雑種であるポマトやトパトであり11)、植物バイオテクノロジーの幕開けとなり、様々な展開がみられるようになった12)。植物バイオテクノロジー研究展開の概観は成書にも見られる13)。
図2 プロトプラストに誘導された細胞分裂
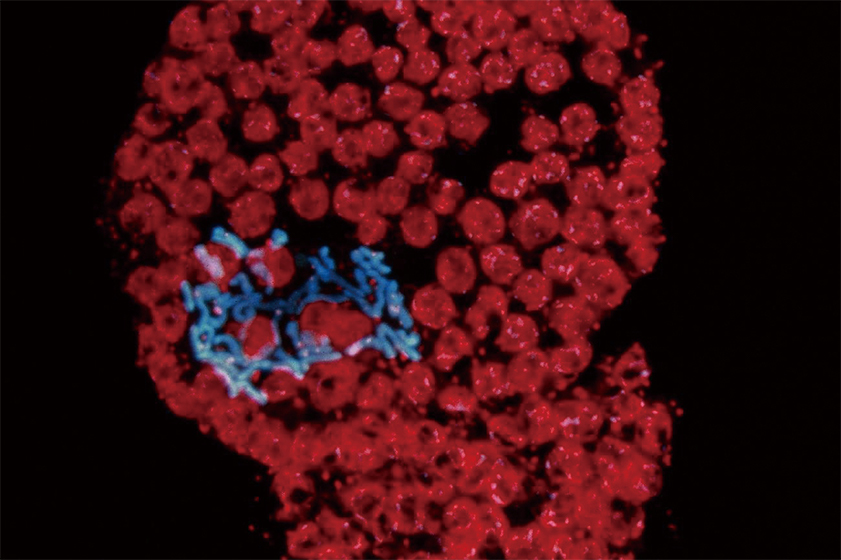
染色体を明瞭に見ることができる。DAPI染色により、紫外線照射の下で観察されているので、染色体は青色に見える。赤く見えるのは葉緑体。
図3 寒天培地上でコロニーを形成したタバコ葉肉プロトプラスト
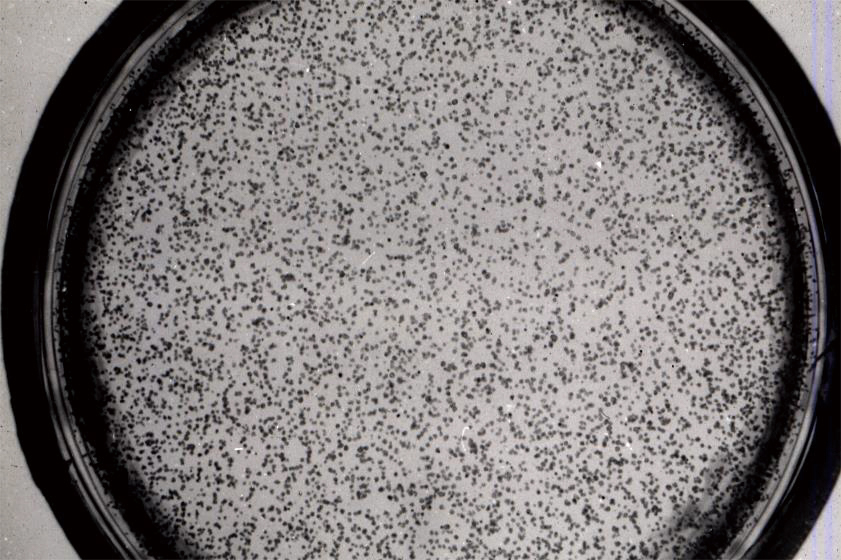
寒天培地に埋め込んだプロトプラストは、60-80%がコロニー形成に至るが、このコロニー形成は細胞密度に依存し、1000個/ml以上で培養する必要がある。
図4 コロニーからの器官形成
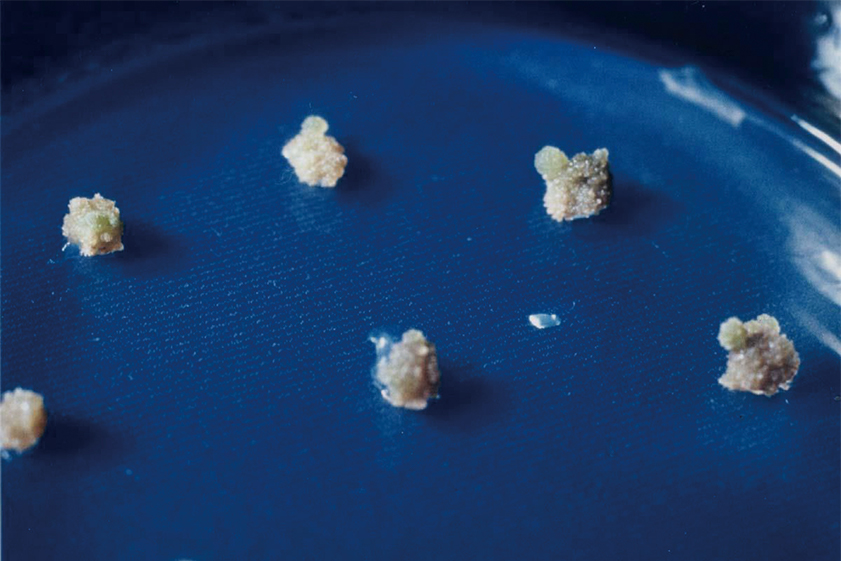
それぞれのコロニーは、オーキシンとサイトカイニンの濃度比を茎葉分化条件に設定すると、茎葉を分化し、やがて、根を形成して幼植物となる。
図5 一つの葉肉細胞プロトプラスト由来の最初に再生された植物体

これは、このようにして再生された植物体であり、1971年4月に撮影された。
プロトプラスト調製の更なる挑戦
プロトプラスト調製におけるマセロチームR-10とセルラーゼ・オノズカR-10の採用は植物科学に新しい展開をもたらした。しかし、酵素処理とは人為的手法であるのでその処理はできる限り簡便・短時間であることが望ましい。そのため、さらなる新しい酵素が探索された。その結果得られた酵素の一つは、醤油製造に用いられるペクトリアーゼY23(協和化成㈱製)である。糸状菌 Aspergillus japonicus より得られたこの酵素は、ポリガラクチュロナーゼとペクチン・リアーゼとからなり、さらにその両者を活性化する因子を含んでいるので、より広範な植物体から細胞単離が可能となった14)。また、タバコBY-2細胞はモデル植物細胞として広範に使用され、高度な細胞周期の同調系が達成された系として、植物におけるヒーラ(HeLa)細胞という名前で世界的に使われるようになった15)。しかしこの細胞からのプロトプラスト調製はセルラーゼ・オノズカR-10では不十分であった。BY-2細胞のプロトプラスト化には、新たに開発されたセルラーゼ・オノズカRS(ヤクルト薬品工業㈱)の使用が必要であることが見出された16)。その結果、もたらされたペクトリアーゼY23とセルラーゼ・オノズカRSの組み合わせは、最も強力な組み合わせで、多くの植物組織・器官よりのプロトプラスト調製を可能にした。それ以外の酵素では抵抗性を示したイネ葉鞘からのプロトプラスト調製を可能にした14)。
形質転換の素材としてのプロトプラスト
形質転換は現代植物科学で不可欠の手法である。プロトプラストへはDNAを導入することにより形質転換が可能であることから、遺伝子導入手段としても広く用いられるようになり、多くの細胞でこの目的のためにプロトプラストが調製された。特に、当初イネ科植物は根頭癌腫菌(Agrobacterium tumefaciens)では形質転換できないとされていたことから、イネプロトプラストは形質転換の材料として用いられた。実際、イネ胚由来のプロトプラストでは植物体再生が示されていたからであり、この系を用いた形質転換も行われた17)。その後、根頭癌腫菌でもイネ科植物での形質転換が可能であることが示されたので18)、イネプロトプラストの重要度は低下したが、なお目的によっては使用され続けている。また、プロトプラストは一過性の遺伝子発見手段としては広範に使用されており、遺伝子発現コンストラクトの発現確認手段として不可欠となっており、現代植物科学のルーティンの手法となっている。
プロトプラスト実験系の今日的意義
プロトプラスト調製が多くの植物材料でなされ、そのさまざまな展開が学術誌に登場した状況からすると、今日の状況は大分沈静化したように見受けられるが、プロトプラストを用いなければできないような実験系があることを喚起したい。
植物細胞の細胞学的特徴は、液胞が存在することであり、液胞の存在は様々な影響を及ぼすと推測されてきた。しかし、液胞が除かれた細胞は存在しなかったので、影響は推測の域を出なかった。ところが、タバコBY-2 プロトプラストを超遠心場に置くと、比重の軽い液胞は、比重の重い細胞質や核の存在分画を含むプロトプラストから除かれることが示され、液胞のない細胞が実験手段として利用できるようになった19)。この液胞が除かれたミニプロトプラストは様々な興味ある挙動を示しているが、このプロトプラストから調製された無細胞系 (Cell-free extracts) に、TMVに近縁のトマトモザイクウイルス (ToMV)を加えると、インビトロでのTOMV増殖が観測された20)。動物細胞では、動物ウイルスのインビト口増殖系は達成されて久しいが、植物細胞でのウイルス増殖の初めてのインビトロ増殖系の確立である。これは植物細胞に存在する液胞の存在がそのようなインビトロ系の調製を阻害していることを明確に示している。このような実験系の存在は、植物ウイルス増殖の詳細な分子機構解明につながると期待される。
一方、イネ培養細胞から調製されたプロトプラストに、エレクトロポレーションにより、TMV-RNA、キュウリモザイクウイルス (CMV) -RNAを導入すると、CMVは増殖するのにTMVは増殖しなかった。これは、TMVは、イネ細胞では増殖できないためと推定される。ところが、イネプロトプラストにTMV-RNAとCMV-RNAを同時に導入するとCMVが増殖している細胞ではTMVの増殖を観測することができた。このことは、イネ細胞で通常TMVの増殖が抑制されているが、CMVが増殖することにより、TMV増殖抑制が解除されTMVが増えることができるようになったと推定される21)。この機構解明はなお今後の課題であるが、植物細胞ではウイルス増殖の抑制とその解除が見られた初めての系であり、進展著しいマイクロRNAの分子機構解明に関する極めて重要な系であることを示している。
おわりに
プロトプラストの研究は、植物バイオテクノロジーの一手法として広く展開されるようになったが、それ以外にも、述べたようにプロトプラストでなければできないような実験系があることは注目すべきである。これらの系の活用によりもたらされる情報は大変貴重であり、植物科学に基本的な貢献がもたらされると期待される。その調製手段としてヤクルト薬品工業㈱の製造するマセロチーム R-10、セルラーゼ・オノズカ R-10が登場してすでに50年が経過し、セルラーゼ・オノズカ RSからしても、36年経っているが、そのような長命を保っている研究手法は進歩の速度の大変早い生命科学においては大変稀なできごとではないかと思う。この分野に初期から関わってきたものとして、大いなる感慨をもってこれらの事実をお伝えしたいと思い本稿をまとめた。
(2018年7月寄稿)
引用文献
-
1) Küster, E.:Ber. Deutsch. Bot. Gesell. 27,589(1909)
-
2) Cocking, E.C. :Nature 187, 962(1960)
-
3) Takebe, I., Otsuki, Y., Aoki, S. :Plant Cell Physiol. 9, 115(1968)
-
4) Takebe, I., Otsuki, Y.:Proc. Natl. Acad. Sci. USA 84, 643(1969)
-
5) Fischer, E.P., Lipson, C.: Thinking about Science - Max Delbrück and the Origin of Molecular Biology, W.W. Norton & Co.(1988)
(邦訳は、分子生物学の誕生、石館・石館訳、朝日新聞社、1993) -
6) Harberlandt, G.:In:Plant Tissue Culture - 100 Years since Gottlieb Harberlandt, Laimer, M,, Rücker, W. (eds.), Springer-Verlag, Wien(2002)
-
7) White, P.R.: The Cultivation of Animal and Plant Cells, Ronald Press(1964)
-
8) Nagata, T., Takebe, I. :Planta 92, 201(1970)
-
9) Nagata, T., Takebe, I:Planta 99, 12(1971)
-
10) Melchers, G., Sacristán, M.D., Holder, A.A.:Carlsberg Res. Comm. 44, 127(1979)
-
11) Nagata, T., Bajaj, Y.P.S.(eds.): Biotechnology in Agriculture and Forestry, Vol. 49, Springer-Verlag, Heidelberg(2002)
-
12) Shephard, J., Bidney, D., Shahin, E. :Science 208, 17(1980)
-
13) 長田敏行:植物プロトプラストの細胞工学、講談社サイエンティフィク(1993)
-
14) Nagata, T., Ishii, S. :Can. J. Bot. 57, 1820(1979)
-
15) Nagata, T., Nemoto, Y., Hasezawa, S.: Int. Rev. Cytol. 132, 1(1992)
-
16) Nagata, T., Okada, K., Takebe, I., Matsui, C. :Mol. Gen. Genet. 184, 161(1981)
-
17) Shimamoto, K., Terada, R., Izawa, T., Fujimoto, H. :Nature 338, 274(1989)
-
18) Hiei, Y., Komari, T., Kubo, T.: Plant Mol. Biol. 35, 205(1997)
-
19) Sonobe, S. :Protoplasma 155, 239(1990)
-
20) Komoda, K., Naito, S., Ishikawa, M.:Proc. Natl. Acad. Sci. USA 101, 1863(2004)
-
21) Okada, K., Nagata, T., Takebe, I.:Plant Cell Rep.7, 333(1988)
